Из чего состоит белки. Белки: начинаем с теории
Из чего состоит белки. Белки: начинаем с теории
Как уже неоднократно упоминалось в прошлых материалах, пища попадает в организм человека в виде нутриентов: белков, жиров, углеводов , витаминов , минералов. Но еще ни разу не упоминалась информация о том, а в каком количестве нужно потреблять те или иные вещества, чтобы добиться определенных целей. Сегодня речь пойдет и об этом.
Если говорить об определении белка, то самым простым и понятным будет высказывание Энгельса относительно того, что существование белковых тел и есть жизнь. Тут сразу становится понятно, нет белка – нет жизни. Если же рассматривать это определение в плоскости бодибилдинга, то без белка не будет и рельефных мышц. А теперь самое время немного погрузиться в науку.
Белок (протеин) представляет собой высокомолекуляные органические вещества, которые состоят из альфа-кислот. Эти мельчайшие частицы соединяются в единую цепочку пептидными связями. В состав белка входит 20 видов аминокислот (9 из них незаменимые, то есть они не синтезируются в организме, а остальные 11 – заменимые).
К незаменимым относятся:
- Лейцин;
- Валин;
- Изолейцин;
- Лицин;
- Триптофан;
- Гистидин;
- Треонин;
- Метионин;
- Фенилаланин.
В число заменимых входят:
- Аланин;
- Серин;
- Цистин;
- Аргенин;
- Тирозин;
- Пролин;
- Глицин;
- Аспарагин;
- Глутамин;
- Аспарагиновая и глутаминовая кислоты.
Кроме этих входящих в состав аминокислот существуют еще и другие, не входящие в состав, но играющие важную роль. Например, гамма-аминомасляная кислота участвует в процессе передачи нервных импульсов нервной системы. такой же функцией обладает и диоксифенилаланин. Без этих веществ, тренировка превратилась бы в непонятно что, а движения были бы похожи на беспорядочные рывки амебы.
Наиболее важные для организма (если рассматривать в плоскости метаболизма) аминокислоты:
Лецин;
Изолейцин;
Валин.
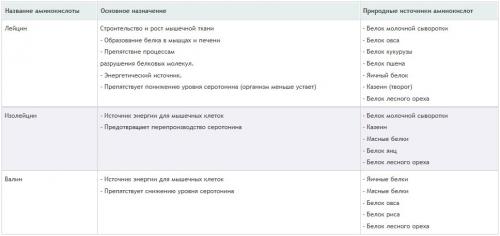
Также эти аминокислоты известны как BCAA .
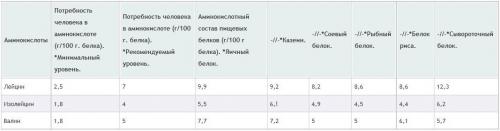
Каждая из трех аминокислот играет важную роль в процессах, связанных с энергетическими составляющими в работе мышц. А чтобы эти процессы проходили максимально правильно и эффективно, каждая из них (аминокислот) должна быть частью ежедневного рациона (вместе с натуральной пищей или в качестве добавок). Дабы ознакомиться с конкретными данными относительно того, в каком количестве нужно потреблять важные аминокислоты, изучите таблицу:
В составе всех белковых веществ находятся такие элементы, как:
- Углерод;
- Водород;
- Сера;
- Кислород;
- Азот;
- Фосфор.
Ввиду этого, очень важно не забывать о таком понятии, как азотистый баланс. Человеческий организм можно назвать своеобразной станцией по переработке азота. А все потому, что азот не только поступает внутрь тела вместе с продуктами питания, но также и выделяется из него (в процессе распада белков).
Разница между количеством потребляемого и выделяемого азота и составляет азотистый баланс. Он может быть, как положительным (когда потребляется большее количество, чем выделяется), так и отрицательном (наоборот). И если хочется набрать мышечную массу и нарастить красивые рельефные мышцы, возможным это будет только в условиях положительного азотистого баланса.
Важно :
В зависимости от того, насколько натренирован атлет, может понадобиться разное количество азота для поддержания необходимого уровня азотистого баланса (на 1 кг массы тела). Усредненные цифры такие:
- Атлет с имеющимся стажем (порядка 2-3 лет) – 2г на 1кг массы тела;
- Начинающий атлет (до 1 года) – 2 или 3г на 1кг массы тела.
Но белок является не только структурным элементом. Он также способен выполнять ряд других важных функций, о которых подробнее речь пойдет далее.
Структура белка. Третичная структура
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии , проверенной 18 апреля 2018; проверки требуют 4 правки .
Разные способы изображения трёхмерной структуры белка на примере фермента триозофосфатизомеразы. Слева — «палочковая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине изображены структурные мотивы: α-спирали и β-листы. Справа изображена контактная поверхность белка, построенная с учётом ван-дер-ваальсовых радиусов атомов; цветами показаны особенности активности участковТретичной структурой белка называется способ укладки полипептидной цепи в пространстве. По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки — вытянутую (форма палочки, веретена).
Однако конфигурация третичной структуры белков еще не дает основания думать, что фибриллярные белки имеют только β-структуру, а глобулярные α-спиральные. Есть фибриллярные белки, имеющие спиральную, а не слоисто-складчатую вторичную структуру. Например, α-кератин и парамиозин (белок запирательной мышцы моллюсков), тропомиозины (белки скелетных мышц) относятся к фибриллярным белкам (имеют палочковидную форму), а вторичная структура у них — α-спираль; напротив, в глобулярных белках может быть большое количество β-структур.
Спирализация линейной полипептидной цепи уменьшает ее размеры примерно в 4 раза; а укладка в третичную структуру делает ее в десятки раз более компактной, чем исходная цепь.
Третичная структура в значительной степени определяется первичной структурой . Усилия по предсказанию третичной структуры белка, основываясь на его первичной структуре, известны как задача предсказания структуры белка . Окружающая среда, в которой белок сворачивается, существенно влияет на его конечную форму, но обычно непосредственно не принимается во внимание текущими методами предсказания. Большинство таких методов полагаются на сравнения с уже известными структурами, и таким образом учитывают влияние окружающей среды косвенно.
В стабилизации третичной структуры белка принимают участие:
Третичную структуру имеют также многие молекулы нуклеиновых кислот ; в частности, универсальную третичную структуру имеют молекулы тРНК .
Белки биохимия. Как удалить белки из раствора?
Чтобы выделить белки из раствора или разделить белки по физико-химическим свойствам достаточно удалить один или оба фактора, обеспечивающих их растворимость - заряд и гидратную оболочку . Так как растворимость белков зависит только от них, то исчезновение одного или обоих этих факторов ведет к полному или частичному осаждению белка и, конечно, к потере его функций. Некоторые способы осаждения позволяют впоследствии восстановить нативные свойства и работоспособность белков.
Обратимость осаждения белков обусловлена сохранением первичной структуры белка. Восстановление физико-химических и биологических свойств белка называется ренативация (ренатурация) . Иногда для ренативации достаточно просто удалить повреждающий агент.
Денатурация
Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции.
1. Физическая денатурация
Вызывается повышением температуры, ультрафиолетовым и микроволновым излучением, механическими воздействиями, ионизацией заряженными частицами.
2. Химическая денатурация
Зависит от природы денатурирующего реагента:
- кислоты и щелочи образуют водородные связи с пептидными группами,
- органические растворители образуют водородные связи и вызывают дегидратацию,
- алкалоиды образуют связи с полярными группами и разрывают систему водородных и ионных связей,
- тяжелые металлы взаимодействуют с заряженными радикалами, нейтрализуют отрицательные заряды и разрывают систему водородных и ионных связей.
На эффекте химической денатурации основаны устаревшие, но простые и наглядныеи, используемые ранее в клиникo-лабораторной диагностике для оценки состава белков крови.
Высаливание
Высаливание – это добавление к раствору белка нейтральных солей (Na2SO4, (NH4)2SO4). Механизм высаливания заключается во взаимодействии анионов (SO42-) и катионов (Na+, NH4+) с зарядами белка (группы NH4+и COO–). В результате заряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно резко уменьшается гидратная оболочка. Все это приводит к "слипанию" молекул и осаждению.
Соли в низких концентрациях способны взаимодействовать с ионными группами белков, отвечающих за внутримолекулярные взаимодействия, приводить к их раскрытию и повышать растворимость.
Так как белки плазмы крови отличаются по размерам, заряду, строению, то можно подобрать такие количества соли, которые вызовут осаждение менее устойчивых белков, пока другие еще будут растворены.
Например, раньше в диагностических целях так определяли соотношение белковых фракций альбумины/глобулины в плазме крови. Альбумины, как более полярные молекулы, остаются в растворенном состоянии при 50% насыщении раствора нейтральными солями, в то время как глобулины в этих условиях уже осаждаются. В норме соотношение альбумины/глобулины в плазме крови равно 1,2-1,8.
Осаждение водоотнимающими средствами
При добавлении водоотнимающих средств (ацетон, этанол) происходит отнятие у белка гидратной оболочки , но не заряда. Растворимость несколько снижается, но денатурации не наступает. Например, в этом заключается антисептическое действие этанола.
Изменение рН
Мягкое изменение рН до изоэлектрической точки белка ведет к исчезновению заряда , одновременному уменьшению гидратной оболочки и, как следствие, снижению растворимости молекулы.
Белки функции. Ферменты
Стоит сказать кратко о каталитической функции белков. Ферменты или энзимы выделяют в особую группу белков. Они осуществляют катализ – ускорение протекания химической реакции.
В соответствии со строением ферменты могут быть:
- простыми – содержат только аминокислотные остатки;
- сложными – помимо белкового мономерного остатка включают небелковые структуры, которые называются кофактором (витамины, катионы, анионы).
Молекулы ферментов имеют активную часть (активный центр), связывающую белок с веществом – субстратом. Каждый фермент «узнаёт» определённый субстрат и связывается именно с ним. Активный центр обычно представляет собой «карман», в который попадает субстрат.
Связывание активного центра и субстрата описывается моделью индуцированного соответствия (модель «рука-перчатка»). Модель показывает, что фермент «подстраивается» под субстрат. Благодаря изменению структуры снижаются энергия и сопротивление субстрата, что помогает ферменту легче перенести его на продукт.
Рис. 3. Модель «рука-перчатка».
Активность ферментов зависит от нескольких факторов:
- температуры;
- концентрации фермента и субстрата;
- кислотности.
Различают 6 классов ферментов, каждый из которых взаимодействует с определёнными веществами. Например, трансферазы переносят фосфатную группу от одного вещества к другому.
Ферменты могут ускорять реакцию в 1000 раз.
Что мы узнали?
Выяснили, какие функции выполняют белки в клетке, как они устроены и как синтезируются. Белки представляют собой полимерные цепочки, состоящие из аминокислот. Всего известно 200 аминокислот, но белки могут образовывать только 20. Белковые полимеры синтезируются на рибосомах. Белки выполняют важные функции в организме: переносят вещества, ускоряют биохимические реакции, контролируют процессы, происходящие в организме. Ферменты связывают субстрат и целенаправленно переносят его на вещества, ускоряя реакции в 100-1000 раз.
Свойства белков. Физико-химические свойства белков
Белки имеют высокий молекулярный вес.
Заряд белковой молекулы. Все белки имеют хоть одну свободную -NH и - СООН группы.
Белковые растворы - коллоидные растворы с разными свойствами. Белки бывают кислыми и основными. Кислые белки содержат много глу и асп, у которых есть дополнительные карбоксильные и меньше аминогрупп. В щелочных белках много лиз и арг. Каждая молекула белка в водном растворе окружена гидратной оболочкой, так как у белков за счет аминокислот есть много гидрофильных группировок (-СООН, -ОН, -NH2, -SH). В водных растворах белковая молекула имеет заряд. Заряд белка в воде может меняться в зависимости от РН.
Осаждение белков. У белков есть гидратная оболочка, заряд, препятствующий склеиванию. Для осаждения необходимо снять гидратную оболочку и заряд.
1.Гидратация. Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объем увеличивается. Набухание белка сопровождается его частичным растворением. Гидрофильность отдельных белков зависит от их строения. Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные амидные (–CO–NH–, пептидная связь), аминные (NH2) и карбоксильные (COOH) группы притягивают к себе молекулы воды, строго ориентируя их на поверхность молекулы. Окружая белковые глобулы гидратная (водная) оболочка препятствует устойчивости растворов белка. В изоэлектрической точке белки обладают наименьшей способностью связывать воду, происходит разрушение гидратной оболочки вокруг белковых молекул, поэтому они соединяются, образуя крупные агрегаты. Агрегация белковых молекул происходит и при их обезвоживании с помощью некоторых органических растворителей, например этило- вого спирта. Это приводит к выпадению белков в осадок. При изменении pH среды макромолекула белка становится заряженной, и его гидратационная способность меняется.